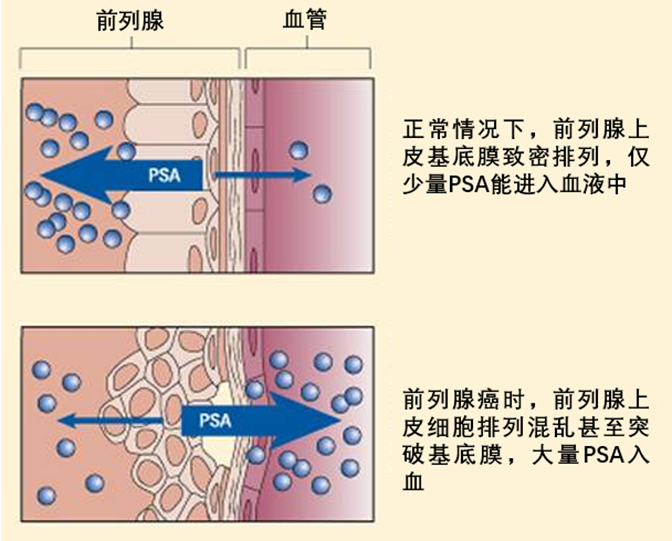
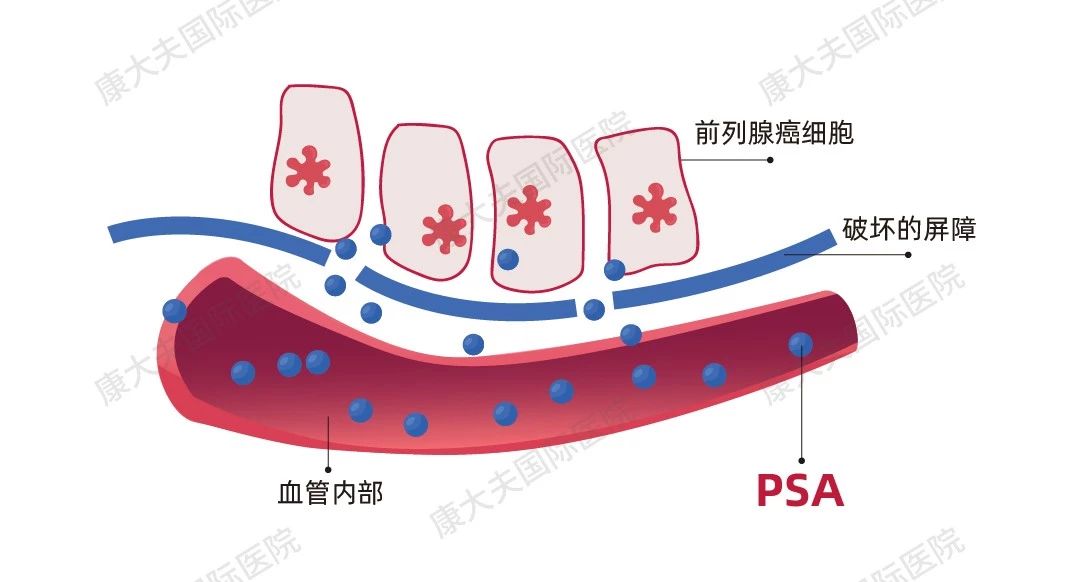
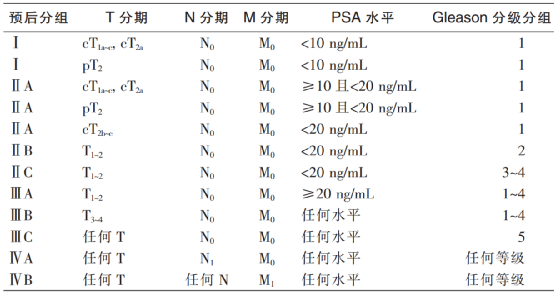
前列腺癌,作为男性常见的恶性肿瘤之一,近年来发病率不断上升。其中,前列腺癌生化复发(Biochemical Recurrence,BCR)是早期前列腺癌治疗后疾病进程变化中的一大挑战。BCR指的是前列腺癌患者在接受局部治疗后(如手术或放射治疗),前列腺特异性抗原(Prostate-Specific Antigen,PSA)水平升高,但无明确癌症病灶或扩散。目前,BCR热点问题包括:新型影像学技术的应用、风险分层指导的个性化治疗及药物强化治疗方案的探索。本文将围绕以上三个热点话题进行分析解读。 BCR的重要性与挑战 BCR是前列腺癌复发的重要信号,但并不意味着肿瘤一定存在临床可见病灶。不同指南对BCR的PSA数值定义尚不统一: ? EAU 2023版指南定义BCR的PSA数值: 根治性前列腺切除术(Radical Prostatectomy,RP)后,PSA值 >0.4ng/mL并且呈上升趋势; 根治性放疗(Radical Radiotherapy,RT) 后,无论是否进行短期激素治疗,对PSA失败的定义是“PSA值比PSA最低值高出2ng/mL以上,无论最低值的血清浓度是多少”。 图1 EAU 2023版指南对于BCR的定义 ? NCCN2024 V2版指南定义BCR的PSA数值: RP后,PSA未能降至无法检测到的水平(PSA持续存在),或者在RP后PSA降至无法检测到的水平后,随后≥2次检测到PSA升高(PSA复发),或者PSA >0.1 ng/mL。 RT后,1)PSA在最低值基础上增加2 ng/mL或更多;2)即使PSA在最低值基础上增加的幅度尚未达到2 ng/mL,也应考虑进行复发评估,特别是在年轻且健康、适合接受二次局部治疗的患者中。 图2 NCCN2024前列腺癌V2版指南对于BCR的定义 前列腺癌根治术后,患者可能面临BCR风险,根据《前列腺癌药物去势治疗随访管理中国专家共识(2024版)》[1],BCR不仅预示着可能的疾病复发或转移,还提示需重新调整治疗策略。 若患者在根治术后出现BCR,应结合影像学检查进行全面评估,以判断是否已发生临床复发。而对于已经发生BCR而没有检测到病灶的患者,可能错过早期挽救性治疗时机,进而影响患者的生活质量和预期寿命。基于患者的风险分层,制定个性化治疗方案是控制病情、甚至实现再次根治的关键。 因此,BCR阶段是疾病治疗的关键期,需要更密切的随访以确保患者及时获得有效治疗,进而优化治疗效果。 一、新型影像学技术—利用精准影像诊断利器PSMA PET成像,更早识别BCR阶段微转移影像学进展 PSMA PET成像利用前列腺特异性膜抗原(PSMA)作为靶点,可在PSA水平较低时即检出前列腺癌灶。目前,美国食品药品监督管理局(FDA)已批准五种PET示踪剂用于诊断前列腺癌患者:Ga-68 PSMA-11(PSMA-HBED-CC)、F-18 piflufolastat(DCFPyL)、C-11胆碱、F-18氟环丙氨酸(fluciclovine)和F-18氟化钠。但NCCN指南仅推荐两种PSMA示踪剂:Ga-68PSMA-11和18F-DCFPy,它们在BCR检测微转移灶方面,相对于传统成像(CT、MRI)具有更高的灵敏度和特异性,尤其在PSA水平较低时也表现突出。 ? PSMA PET检出率与PSA水平密切相关[2-5] 在PSA水平较低时,PSMA PET仍能表现出较高的检出率。例如68Ga-PSMA-11,当PSA≤2 ng/mL时,68Ga-PSMA-11的阳性率可达97%;而在PSA为0.2-0.5 ng/mL时,其阳性率仍有58%。PSA低于0.2 ng/mL时检出率为34%[2]。同样,18F-DCFPyL在PSA水平较低时也能检出疾病迹象,其疾病检出率和正确定位率在低PSA值下依然可观,分别为59-66%和85-87%[6]; 此外,较高的PSA值、较短的前列腺特异性抗原倍增时间(Prostate-Specific Antigen Doubling Time,PSADT)以及其他临床病理特征(如Gleason等级、临床T分期)可能与PET-PSMA阳性和盆腔外转移独立相关[7-9]。如文献中提示当根治性治疗后患者PSA>0.15 ng/mL、PSADT≤12个月、且Gleason评分≥7时,检出率最高,可以考虑行PSMA PET检查[8]。这些发现为PSMA PET在BCR诊断中的应用提供了重要依据。 ? 临床应用:指导治疗决策 在BCR患者中,结合PSA水平、PSADT、Gleason评分和临床T分期等综合因素,使用PSMA PET进行诊断检查具有重要意义。 目前还有多项正在进行中的临床研究[10],期待给我们带来更多的临床指导。



二、BCR风险分层个性化治疗:风险分层助力更优治疗方案选择
为了深入理解BCR的风险及其与前列腺癌特异性死亡(Prostate Cancer-Specific Mortality,PCSM)的关系,一项队列研究纳入了2003年至2018年期间接受放疗或根治性前列腺切除术的患者,并进行了长期随访[11]。基于诊断时的D’Amico风险组,研究者评估了BCR的累积发生率,并构建了竞争风险回归模型,以验证EAU-BCR风险分层并评估其与PCSM的相关性。
本研究是首次基于人群的研究,评估了根治性前列腺切除术和放疗后BCR的风险分层与PCSM之间的关联。
? 研究结果
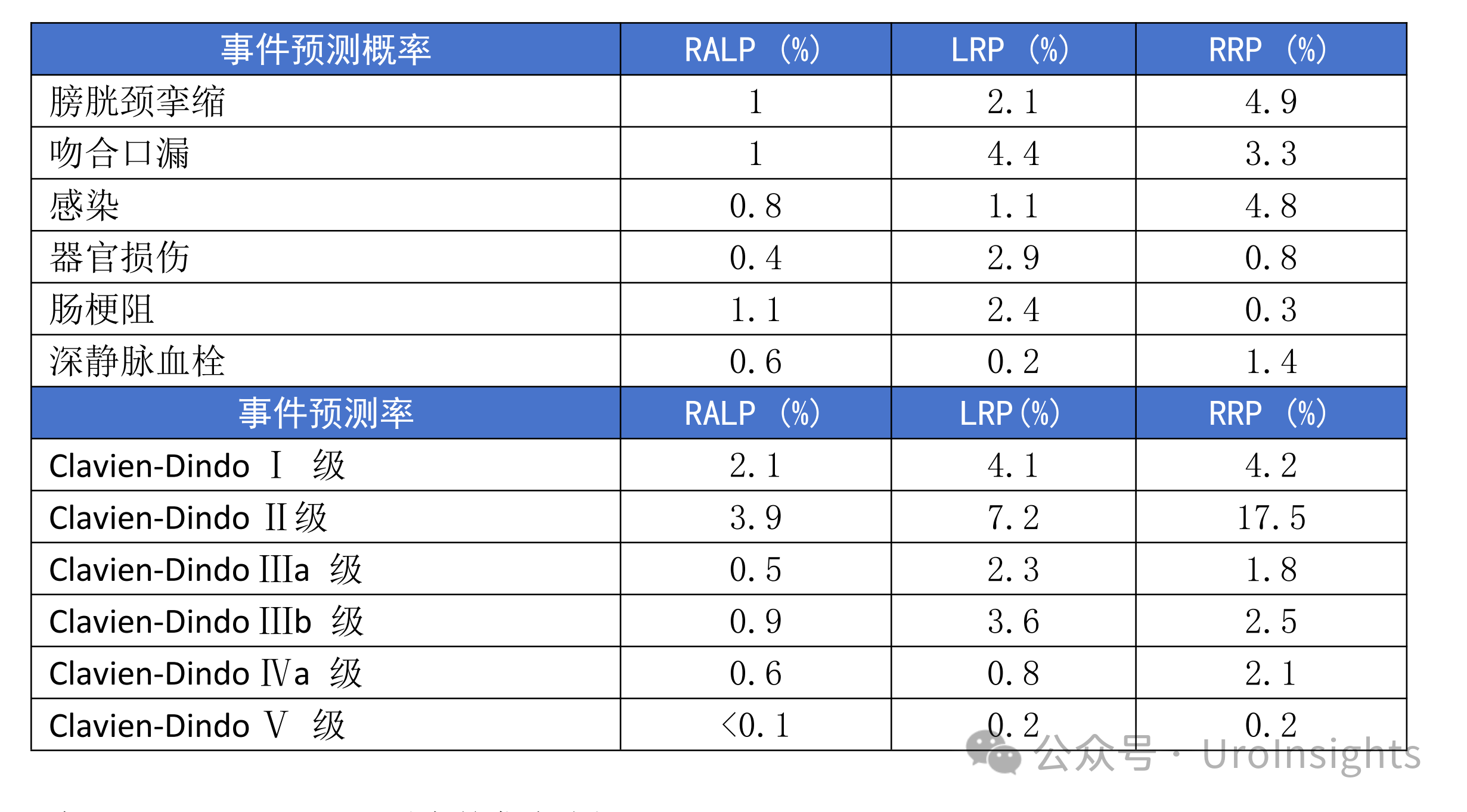
1) 在根治性前列腺切除术后,低、中、高D’Amico风险组的15年BCR累积发生率分别为16%、30%和46%。与未经历BCR的患者相比,EAU-BCR高风险是PCSM(次分布风险比[sHR],1.27;95% CI,1.02-1.59)的一个危险因素,而EAU-BCR低风险则不是PCSM的危险因素(sHR,1.18;95% CI,0.96-1.46)(见下表)。

? 研究结论
根治性前列腺切除术后EAU- BCR低风险的患者与无BCR的患者相比,PCSM风险相似,并可能被视为无临床显著复发的患者。值得注意的是,根治性前列腺切除术后的BCR累积发生率高于放疗。然而,放疗后BCR患者的PCSM风险显著增高。
? 研究提示
BCR的风险分层对于指导挽救性治疗决策、减少过度治疗以及制定初始治疗后PSA升高时的分期检查至关重要。
三、强化内分泌治疗在BCR阶段的应用考量
BCR患者指南推荐的标准治疗方案是放疗,根据患者情况考虑是否联用雄激素剥夺治疗(Androgen Deprivation Therapy,ADT)。然而,随着新一代口服非类固醇类雄激素受体抑制剂,如阿帕他胺(apalutamide)和恩扎卢胺(enzalutamide)的出现,内分泌治疗的策略正在发生转变。这些雄激素受体抑制剂常与ADT联合用于晚期前列腺癌患者,但最新的研究正探索其在BCR阶段的应用潜力。
1. Aggarwal R等人的研究为我们提供了宝贵的见解。他们进行了一项开放标签、多中心、随机的2期试验[12],旨在比较ADT单药、ADT联合阿帕他胺以及阿帕他胺单药治疗在PSADT≤12个月的BCR患者中的疗效。经过约30个月的中位随访时间,尽管未能在主要终点观察到统计学差异,但数据显示,与阿帕他胺单药(25.8个月)或ADT单药(30.9个月)相比,阿帕他胺与ADT联合使用的患者PSA进展中位时间更长(36.1个月)(HR 0.56,95% CI:0.23-1.36,P=0.196),表明联合治疗可能为患者带来潜在益处。
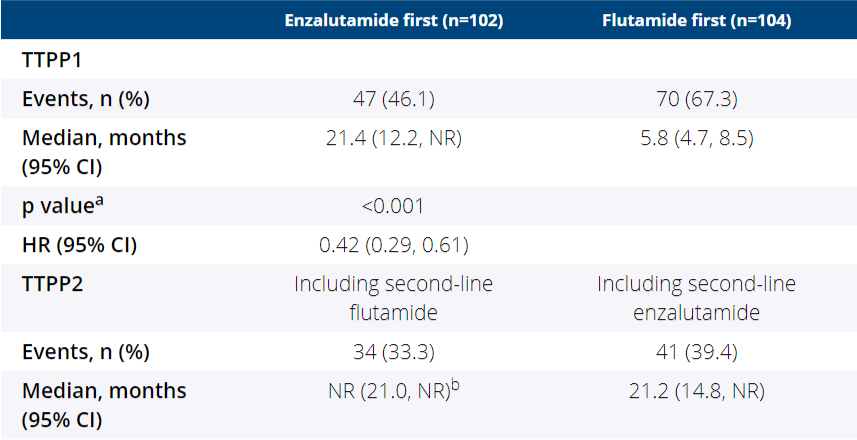
2. EMBARK试验则为我们提供了更为明确的证据[13]。在这项研究中,1068名高危BCR患者被随机分配至恩扎卢胺+ADT、安慰剂+ADT或恩扎卢胺单药治疗组。中位随访时间长达60.7个月,结果显示,与安慰剂+ADT相比,无论先前的内分泌治疗、根治性前列腺切除术、基线PSA、PSADT或年龄如何,恩扎卢胺单药治疗和恩扎卢胺+ADT分别显著降低了36.9%(HR 0.63,95% CI(0.46-0.87),P=0.005)和57.6%(HR 0.42,95% CI 0.31-0.61,P<0.001)的转移或死亡风险。
此外,ADT联合恩扎卢胺相比单药恩扎卢胺明显改善了PSA进展(HR 0.07,95% CI 0.03-0.14,P<0.001)和首次使用新型抗肿瘤药物的时间(HR 0.36,95% CI 0.26-0.49,P<0.001)。总体而言,恩扎卢胺单药治疗和恩扎卢胺+ADT的组合降低了转移、死亡、PSA进展、首次骨骼事件和症状性进展的风险。
EMBARK试验的结果不仅为BCR患者提供了新的治疗选择,也标志着内分泌强化治疗在前列腺癌治疗领域中的逐步前移。
3.目前,针对高危BCR患者的临床研究仍在进行中,旨在探索更强化的系统治疗组合。我们期待这些研究能够为前列腺癌BCR患者带来更多希望与可能。
总结
在BCR的患者管理中,并不存在一种普遍适用的一刀切(one for all)的方法。因此,以下策略显得尤为重要:
1. 精准诊断成像技术:利用PSMA PET成像等先进技术,在PSA值低至0.2 ng/mL时也可敏感检测转移灶,为早期发现和治疗提供依据。
2. 分层管理以识别高风险人群:基于BCR风险因素对患者进行分层,以识别·高风险人群,并据此制定更精准的治疗策略。
3. 个性化治疗:对于有条件的患者,建议进行PSMA PET成像检查以获取精准诊断,进而制定个性化治疗方案。对于无条件检查的高危BCR患者,推荐在疾病早期进行成像检查,并考虑采用新型内分泌治疗(Novel Hormonal Agents,NHA)+ADT的强化策略。
参考文献
1. 前列腺癌药物去势治疗随访管理中国专家 共识(2024版), Chin J Oncol, April 2024, Vol. 46, No. 4
2. CrocerossaF,MarchioniM,NovaraG,etal:Detectionrateofprostatespecificmembraneantigentracersforpositronemissiontomography/computerizedtomographyinprostatecancerbiochemicalrecurrence: Asystematicreviewandnetworkmeta-Analysis.JUrol205:356-369,2021
3. Heying Duan,et a;l. PSMA PET for Detection of Recurrence, January 2024,54(1), 77-86
4. SongH,HarrisonC,DuanH,etal:Prospectiveevaluationof(18)F-DCFPyLPET/CTinbiochemicallyrecurrentprostatecancerinanaca-demiccenter:Afocusondiseaselocalizationandchangesinmanage-ment.JNuclMed61:546-551,2020
5. Perera M, Papa N, Roberts M, Williams M, Udovicich C, Vela I, et al. Gallium-68 Prostate-specific Membrane Antigen Positron Emission Tomography in Advanced Prostate Cancer—Updated Diagnostic Utility, Sensitivity, Specificity, and Distribution of Prostate-specific Membrane Antigen-avid Lesions: a Systematic Review and Meta-analysis. European Urology. 2020? 77: 403–417
6. MORRisMJ,RoweSP,GorinMA,etal:Diagnosticperformanceof(18)F-DCFPyL-PET/CT in men with biochemically recurrent prostate cancer: Results from the CONDOR phase III,multi center study.ClinCan-cerRes27:3674-3682,2021
7. Verburg FA, PFSter D, Heidenreich A, Vogg A, Drude NI, Vöö S, et al. Extent of disease in recurrent prostate cancer determined by [(68)Ga] PSMA-HBED-CC PET/CT in relation to PSA levels, PSA doubling time and Gleason score. Eur J Nucl Med Mol Imaging. 2016;43(3):397–403;
8. Burgard C, Hoffmann MA, Frei M, Buchholz HG, Khreish F, Marlowe RJ, et al. Detection effcacy of 68GaPSMA-11 PET/CT in biochemical recurrence of prostate cancer with very low PSA levels: a 7-year, two-center “real-world” experience. Cancers. 2023;15(5):1376
9. Monica Abghari-Gerst, et al, J Nucl Med 2022 Apr;63(4):567-572
10. Arch. Esp. Urol. 2023? 76(10): 733–745
11. Ugo Giovanni Falagario,et al, JAMA Network Open. 2023;6(9):e2332900
12. Aggarwal R, Alumkal JJ, Szmulewitz RZ, Higano CS, Bryce AH, Lopez-Gitlitz A, et al. Randomized, open-label phase 2 study of apalutamide plus androgen deprivation therapy versus apalutamide monotherapy versus androgen deprivation monotherapy in patients with biochemically recurrent prostate cancer. Prostate Cancer. 2022;2022:5454727
13. S.J. Freedland, M,et al. Improved Outcomes with enzalutamide in Biochemically Recurrent Prostate Cancer, N Engl J Med 2023;389:1453-65.